药包材红外、密度、气体透过量、水蒸汽透过量等8个标准草案公示
来源:国家药典委

我委拟制定包装材料红外光谱测定法、密度测定法、气体透过量测定法和水蒸气透过量测定法4个国家药包材标准,为确保标准的科学性、合理性和适用性,现将拟制定的包装材料红外光谱测定法、密度测定法、气体透过量测定法和水蒸气透过量测定法4个国家药包材标准第二次公示征求社会各界意见(详见附件)。公示期为一个月。请相关单位认真研核,若有异议,请及时来函提交反馈意见,并附相关说明、实验数据和联系方式。来函需加盖公章,收文单位为“国家药典委员会办公室”,同时将公函扫描件电子版发送至指定邮箱。公示期满未回复意见即视为对公示标准草案无异议。
联系人:康笑博
电 话:010-67079620
电子邮件:421@chp.org.cn
收文单位:国家药典委员会办公室
地 址:北京市东城区法华南里11号楼
邮 编:100061
附件:包装材料红外光谱测定法公示稿(第二次).pdf
密度测定法公示稿(第二次).pdf
气体透过量测定法公示稿(第二次).pdf
水蒸气透过量测定法公示稿(第二次).pdf
包装材料红外光谱测定法
红外分光光度法是在一定波数范围内测定物质的吸收光谱,主要用于药品包装材料的鉴 别。药品包装材料的红外光谱检测方法有透射和衰减全反射(Attenuated Total Reflection, ATR)等。透射是指通过测定透过供试品前后的红外光强度变化,得到红外透射光谱。衰减 全反射是指红外光以一定的入射角度通过 ATR 晶体后,在与晶体紧贴的供试品表面经过多 次反射而得到反射光谱图,可分为单点衰减全反射和平面衰减全反射。透射法一般测定 4000-400cm-1 波数范围内的吸收光谱,衰减全反射法一般测定 4000-650cm-1 波数范围内的吸 收光谱。
仪器及其校正
仪器及其校正照红外分光光度法(通则 0402)要求。
供试品的制备及测定 通常采用热敷法、膜法、热裂解法、衰减全反射法、显微红外法等方法进行测定。
第一法热敷法
本法适用于塑料产品及粒料的红外光谱测定。除另有规定外,将溴化钾晶片或其它适宜
盐片加热后,趁热将供试品轻擦于热溴化钾晶片或其它适宜盐片上,以不冒烟为宜。常采用 透射法进行测定。
第二法膜法
本法适用于塑料产品及粒料的红外光谱测定。除另有规定外,取供试品适量,制成厚度 适宜均一的薄膜,常采用透射法进行测定。常用的薄膜制备方式可采用热压成膜,或者加适 宜溶剂高温回流使供试品溶解,趁热将回流液涂在溴化钾晶片上或其它适宜盐片上,加热挥 去溶剂等方式。
第三法热裂解法
本法适用于橡胶产品的红外光谱测定。除另有规定外,取供试品切成小块,用适宜溶剂 抽提后烘干,再取适量置于玻璃试管底部后于酒精灯上加热,当裂解产物冷凝在玻璃试管冷 端时,用毛细管取裂解物涂在溴化钾晶片或其它适宜盐片上,立刻采用透射法进行测定。
第四法衰减全反射法(ATR 法)
本法适用于塑料产品及粒料、橡胶产品的红外光谱测定。除另有规定外,取表面清洁平 整的供试品适量,与衰减全反射棱镜底面紧密接触,采用衰减全反射法进行测定。
第五法显微红外法
本法适用于多层膜、袋、硬片等产品的红外光谱测定。除另有规定外,用切片器将供试 品切成厚度小于 50μm 的薄片,置于显微红外仪上观察供试品横截面,选择所需检测的区域, 进行测定。
起草单位:上海市食品药品包装材料测试所 复核单位:江西省药品检验检测研究院
电话:021-50798250
密度测定法
密度系指在规定温度下单位体积物质的质量。温度为 t°C时的密度用ρt 表示,单位为 kg/m3、g/cm3。密度是药品包装材料的特性之一,可用于药品包装材料的鉴别。
药品包装材料的密度一般采用浸渍法测定。浸渍法系指供试品在规定温度的浸渍液中, 所受到浮力的大小,等于供试品排开浸渍液的体积与浸渍液密度的乘积。而浮力的大小可以 通过测量供试品的质量与供试品在浸渍液中的质量求得。
本法适用于除泡沫塑料以外的塑料容器(材料)的密度测定。
仪器
精度为 0.1mg 的天平,附密度测定装置(温度计的最小分度值为 0.5°C). 供试品的制备及测定供试品应在 23°C±2°C,相对湿度 50%±5%环境中放置 4 小时以上,然后在此条件下进行试验。供试品为除粉料以外的任何无气孔材料,表面应光滑平整、无凹陷,清洁,无裂缝,无气泡等缺陷。尺寸适宜,供试品质量不超过 2g。浸渍液应选用新沸放冷水或其他适宜的液体,不与供试品作用的液体,必要时可加入润湿剂,但应小于浸渍液总体积的 0.1%,以除去小气泡。在测试过程中,供试品与该液体接 触时,对供试品应无影响。供试品上端距浸渍液液面应不小于 10mm,供试品表面不能粘附 空气泡。浸渍液密度应小于供试品密度;当材料密度大于 1 时可选用水或者无水乙醇,当材 料密度小于 1 时可选用无水乙醇。
取供试品适量,置于天平上,精密测定其在空气中的质量(a),然后将供试品置于盛有 一定量已知密度(ρx)的浸渍液(水或无水乙醇)中,精密测定其质量(b),按下式计算 容器(材料)的密度。

【附注】水及无水乙醇在不同温度下的密度见表 1、表 2。
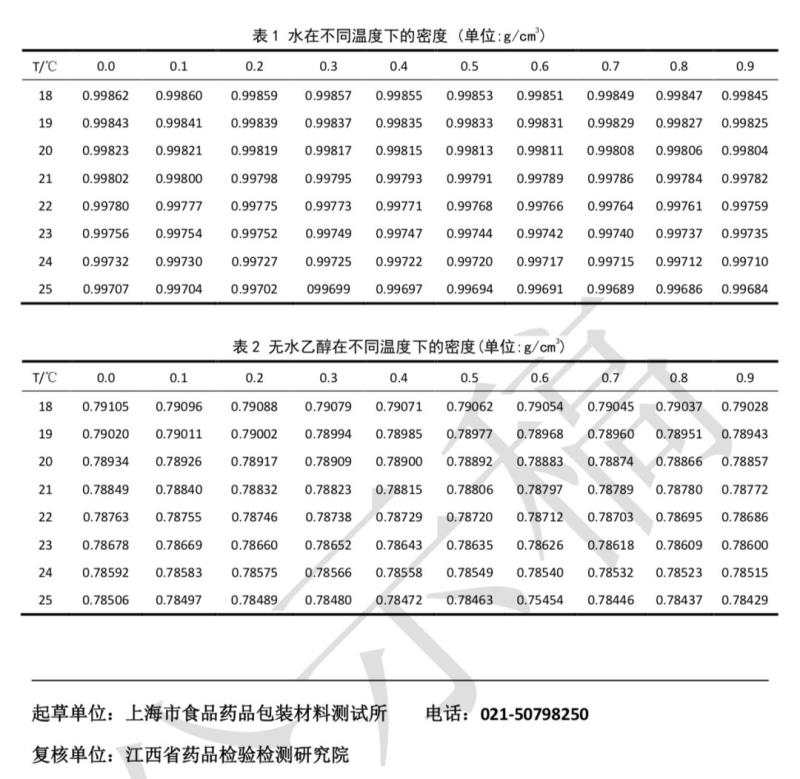
气体透过量测定法
本法用于测定药用薄膜或薄片的气体透过量。本法包括压差法和电量分析法。电量分 析法仅适用于检测氧气透过量。
气体透过量系指在恒定温度和单位压力差下,在稳定透过时,单位面积和单位时间内 透过供试品的气体体积。通常以标准温度和 1 个标准大气压下的体积值表示,单位为: cm3/(m2·24h·0.1MPa)。
气体透过系数系指在恒定温度和单位压力差下,在稳定透过时,单位面积和单位时间 内透过单位厚度供试品的气体体积。通常以标准温度和 1 个标准大气压下的体积值表示, 单位为:cm3·cm/(m2·24h·0.1MPa)。
测试环境:温度:(23±2) °C,相对湿度:(50±5) %
第一法 压差法 药用薄膜或薄片将低压室和高压室分开,高压室充约 0.1MPa 的试验气体,低压室的体积已知。供试品密封后用真空泵将低压室内的空气抽到接近零值。用测压计测量低压室的压力增量 Dp ,可确定试验气体由高压室透过供试品到低压室的以时间为函数的气体量,但应排除气体透过速度随时间而变化的初始阶段。
仪器装置 压差法气体透过量测定仪,主要包括以下几部分: 透气室 由上、下两部分组成,当装入供试品时,上部为高压室,用于存放试验气体,装有气体进样管。下部为低压室,用于贮存透过的气体并测定透气过程中的前后压差。测压装置 高、低压室应分别有一个测压装置,高压室的测压装置灵敏度应不低于100Pa,低压室测压装置的灵敏度应不低于5Pa。
真空泵 应能使低压室的压力不大于 10Pa。 试验气体 纯度应大于 99.5%。
测定法 除另有规定外,选取厚度均匀,无褶皱、折痕、针孔及其他缺陷的适宜尺寸的供试品三片,在供试品朝向试验气体的一面做好标记,在 23±2 °C环境下,置于干燥器中, 放置 48 小时以上,用适宜的量具分别测量供试品厚度,精确到 0.001mm,每片至少测量 5 个点,取算术平均值。置仪器上,进行试验。为剔除开始试验时的非线性阶段,应进行 10 分钟的预透气试验,继续试验直到在相同的时间间隔内压差的变化保持恒定,达到稳定透过。
气体透过量(Qg)可由仪器所带的计算机分析软件进行直接计算得到,也可按下式计算:

第二法 电量分析法(库仑计法)
供试品将透气室分为两部分。供试品的一侧通氧气,另一侧通氮气载气。透过供试品的氧气随氮气载气一起进入电量分析检测仪中进行化学反应并产生电压,该电压与单位时 间内通过电量分析检测仪的氧气量成正比。
仪器装置 电量分析法气体透过量测定仪,仪器主要包括以下几部分:
透气室 由两部分构成,应配有测温装置,还需装配适宜的密封件,供试品测试面积根 据测试范围调整,通常应在 1cm2 到 150cm2 之间。
载气 通常为氮气或者含一定比率的氢气和氮气混合气。
试验气体 纯度应不低于 99.5%。 电量检测器(库仑计) 对氧气敏感,运行特性恒定,用来测量透过的氧气量。测定法 除另有规定外,选取厚度均匀、平整、无褶皱、折痕、针孔及其他缺陷的适宜尺寸的供试品三片,在供试品朝向试验气体的一面做好标记,在 23°C±2°C环境下,置于干 燥器中,放置 48 小时以上,用适宜的量具测量供试品厚度,精确到 0.001mm,至少测量 5 个点,取算术平均值。将供试品放入透气室,然后进行试验,当仪器显示的值已稳定一段 时间后,测试结束。
氧气透过率(RO2)可由仪器所带的计算机分析软件进行直接计算得到,也可按下式计 算:

水蒸气透过量测定法
本法用于测定药用包装材料或容器的水蒸气透过量,包括但不限于药用薄膜或薄片及药 用包装容器的水蒸气透过量测定。水蒸气透过量系指在规定的温度、相对湿度、一定的水蒸 气压差下,供试品在一定时间内透过水蒸气的量。
本法包括重量法、电解分析法和红外检测器法。如不同测试方法可适用,但测试结果不 一致时,应以红外检测器法的测试结果为准。
第一法 重量法
本法主要有基于干燥剂的增重法和基于水溶液的减重法来进行测定的两类方法。
1.增重法 测定在规定的温度、相对湿度环境下,通过材料或容器透入的水蒸气量,通 常用干燥剂的重量增重来计算。增重法通常又可分为杯式法和容器法两种。
(1)杯式法 系指将供试品固定在特制的装有干燥剂的透湿杯上,通过透湿杯的重量增 量来计算药用薄膜或薄片的水蒸气透过量。一般适用于水蒸气透过量不低于 2 g/(m2·24h) 的薄膜或薄片。
仪器装置
恒温恒湿箱 温度精度为±0.6°C;相对湿度精度为±2%;风速为 0.5~2.5m/s;恒温 恒湿箱关闭后,15 分钟内应重新达到规定的温、湿度。
分析天平 灵敏度为 0.1mg。
透湿杯 如图 1。应由质轻、耐腐蚀、不透水、不透气的材料制成;有效测定面积不得 低于 25 cm2。
试验条件 常用试验条件如下: A:温度 23°C±2°C,相对湿度 90%±5% B:温度 38°C±2°C,相对湿度 90%±5%
测定法 除另有规定外,选取厚度均匀,无皱褶、折痕、针孔及其他缺陷的供试品三片, 分别用圆片冲刀冲切,供试品直径应介于杯环直径与杯子直径之间。将干燥剂放入清洁的杯 皿中,加入量应使干燥剂距供试品表面约 3mm 为宜。将盛有干燥剂的杯皿放入杯子中,然后 将杯子放到杯台上,供试品放在杯子正中,加上杯环后,用导正环固定好供试品的位置,再 加上压盖。小心地取下导正环,将熔融的密封蜡浇灌至杯子的凹槽中,密封蜡凝固后不允许 产生裂纹及气泡。待密封蜡凝固后,取下压盖和杯台,并清除粘在透湿杯边及底部的密封蜡。在 23°C±2°C环境中放置 30 分钟,称量封好的透湿杯。将透湿杯放入已调好温度、湿度的 恒温恒湿箱中,16 小时后从箱中取出,放在处于 23°C±2°C环境中的干燥器中,平衡 30 分 钟后进行称量,称量后将透湿杯重新放入恒温恒湿箱内,以后每两次称量的间隔时间为 24、 48 或 96 小时,称量前均应先放在处于 23°C±2°C环境中的干燥器中,平衡 30 分钟。直到前 后两次质量增量相差不大于 5%时,方可结束试验。同时取一个供试品进行空白试验。按下 式计算水蒸气透过量(WVT):

[附注]
(1)密封蜡 密封蜡应在温度 38°C、相对湿度 90%条件下暴露不会软化变形。若暴露 表面积为 50 cm2,则在 24h 内质量变化不能超过 1mg。例如:石蜡(熔点为 50~52°C)与蜂 蜡的配比约为 85:15。
(2)干燥剂 无水氯化钙粒度直径为 0.60~2.36mm。使用前应在 200°C±2°C烘箱中, 干燥 2 小时。
(3)每次称量后应轻微晃动杯子中的干燥剂,使其上下混合。
(4)试验结束后,干燥剂吸湿总增量应不得过 10%。
(5)空白试验系指除杯中不加干燥剂外,其它试验步骤同供试品试验。
(2)容器法 系指在规定的温度、相对湿度环境下,包装容器内透入的水蒸气量。一般 适用于口服固体制剂用包装容器,如固体瓶等。
仪器装置
恒温恒湿箱 温度精度为±0.6°C;相对湿度精度为±2%;风速为 0.5~2.5m/s。恒温 恒湿箱关闭之后,15 分钟内应重新达到规定的温、湿度。
分析天平 灵敏度为 0.1mg(当称重量大于 200g 时,灵敏度可不大于 1mg;当称重量大 于 1000g 时,灵敏度可不大于称重量的 0.01%)。
试验条件 常用试验条件如下: A:温度 40°C±2°C,相对湿度 75%±5% B:温度 30°C±2°C,相对湿度 65%±5% C:温度 25°C±2°C,相对湿度 75%±5%
测定法 除另有规定外,取试验容器适量,用干燥绸布擦净每个容器,将容器盖连续开、 关 30 次后,在容器内加入干燥剂:20ml 或 20ml 以上的容器,加入干燥剂至距瓶口 13mm 处; 小于 20ml 的容器,加入的干燥剂量为容积的 2/3,立即将盖盖紧。另取两个容器装入与干 燥剂相等量的玻璃小球,作对照用。容器紧盖后分别精密称定,然后将容器置于恒温恒湿箱 中,放置 72 小时,取出,用干燥绸布擦干每个容器,室温放置 45 分钟,分别精密称定。按 下式计算水蒸气透过量(WVT):

2. 减重法
本法系指在规定的温度、相对湿度环境下,一定时间内容器内水分损失的百分比。一般 适用于口服、外用液体制剂用容器、输液容器等包装容器。
仪器装置 恒温恒湿箱 温度精度为±0.6°C;相对湿度精度为±2%;风速为 0.5~ 2.5m/s。恒温恒湿箱关闭之后,15 分钟内应重新达到规定的温、湿度。
分析天平 灵敏度为 0.1mg (当称重量大于 200g 时,灵敏度可不大于 1mg;当称重量大 于 1000g 时,灵敏度可不大于称重量的 0.01%)。
试验条件 常用试验条件如下: A:温度 40°C±2°C,相对湿度 25%±5% B:温度 25°C±2°C,相对湿度 40%±5% C:温度 30°C±2°C,相对湿度 35%±5% 测定法 除另有规定外,取试验容器适量,在容器中加入水至标示容量,旋紧瓶盖,精密称定。然后将容器置于恒温恒湿箱中,放置 14 天,取出后,室温放置 45 分钟后,精密称 定,按下式计算水分损失百分率:

第二法 电解分析法
本法系指水蒸气遇电极电解为氢气和氧气,通过电解电流的数值计算出一定时间内透过单位面积供试品的水蒸气透过总量的水蒸气透过量分析方法。
仪器装置 水蒸气透过量测定仪,仪器主要包括:
透湿室 上端测试皿为高湿腔,通常包含一个在饱和盐溶液中浸泡过的毛玻璃板,以保 持供试品一端的恒定的湿度环境,下端为与电解槽相通。
电解传感器 可定量测定在其中所携带的水蒸气。试验条件 常用试验条件如下: A:温度 23°C±0.5°C,相对湿度 85%±2% B:温度 38°C±0.5°C,相对湿度 90%±2%
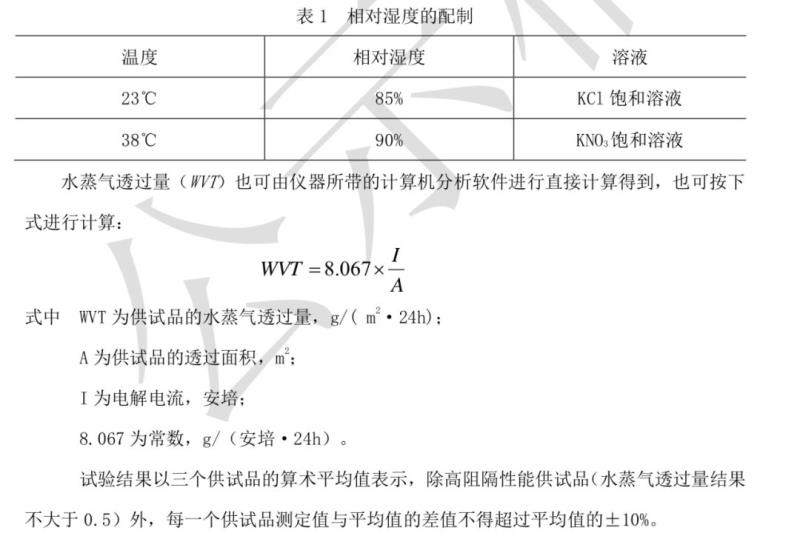
测定法 除另有规定外,选取厚度均匀,无皱褶、折痕、针孔及其他缺陷的供试品三片, 供试品应在 23°C±2°C,相对湿度 50%±10%的条件下,进行供试品调节,调节时间至少 4 小时。按仪器使用说明书,进行试验操作,当显示的值稳定后,测试结束(一般来说,电流 采样值前后两次相差不大于 5%时,可视为达到稳定状态)。所需相对湿度可通过盐溶液调节。常用的温湿度配制方法见表 1。
第三法 红外检测器法
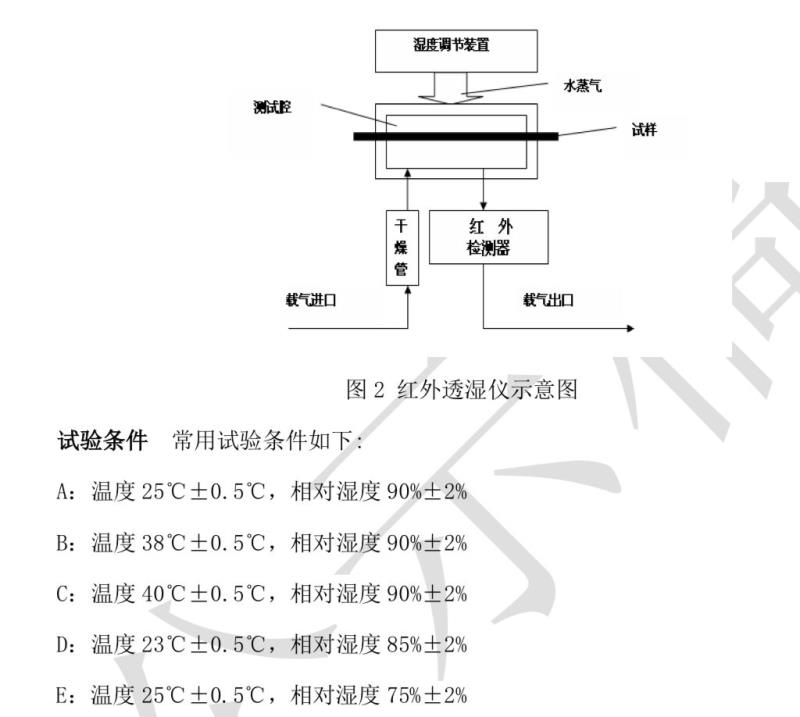
本法适用于药用薄膜或薄片等材料片材的水蒸气透过量的测定。当供试品置于测试腔 时,供试品将测试腔隔为两腔。供试品一边为低湿腔,另一边为高湿腔,里面充满水蒸气 且温度已知。由于存在一定的湿度差,水蒸气从高湿腔通过供试品渗透到低湿腔,由载气传送到红外检测器产生一定量的电信号,当试验达到稳定状态后,通过输出的电信号计算 出供试品水蒸气透过率。
仪器装置 红外透湿仪(图 2),由湿度调节装置、测试腔、红外检测器、干燥管及流量 表等组成。高湿腔的湿度调节可采用载气加湿的方式或饱和盐溶液的方式调节,红外检测器 与低湿腔相连测定水蒸气浓度。红外传感器对水蒸气的灵敏度至少为 1μg/L 或 1mm3/dm3。
测定法:除另有规定外,选取具有代表性、厚度均匀、无皱褶、折痕、针孔及其他缺陷的适宜尺寸的供试品三片,供试品应在 23°C±2°C,相对湿度 50%±10%的条件下,进行供试 品调节,调节时间至少 4 小时。然后进行试验,当仪器显示的值稳定后,测试结束(一般来 说,输出的电压值或仪器显示的水蒸气透过率值前后两次变化相差不大于 5%时,可视为达 到稳定状态。如果连续两次输出值变化未在 5%以内,应在报告里就试验终止情况加以说明)。
水蒸气透过量(WVT)也可由仪器所带的计算机分析软件进行直接计算得到,也可按下 式计算:

试验结果以三个供试品的算术平均值表示,除高阻隔性能供试品(水蒸气透过量结果不大于0.5)外,每一个供试品测定值与平均值的差值不得超过平均值的±10%。
[附注]试验具体操作如零点漂移测定、载气流量调节等应根据所测材料阻隔性能的高低,按照仪器使用说明书的要求进行。
起草单位:上海市食品药品包装材料测试所
复核单位:江西省药品检验检测研究院
我委拟制定药包材急性全身毒性检查法、药包材热原检查法、药包材溶血检查法和药包材细胞毒性检查法4个国家药包材标准,为确保标准的科学性、合理性和适用性,现将拟制定的药包材急性全身毒性检查法、药包材热原检查法、药包材溶血检查法和药包材细胞毒性检查法4个国家药包材标准第二次公示征求社会各界意见(详见附件)。公示期为一个月。请相关单位认真研核,若有异议,请及时来函提交反馈意见,并附相关说明、实验数据和联系方式。来函需加盖公章,收文单位为“国家药典委员会办公室”,同时将公函扫描件电子版发送至指定邮箱。公示期满未回复意见即视为对公示标准草案无异议。联系人:康笑博电 话:010-67079620电子邮件:421@chp.org.cn收文单位:国家药典委员会办公室地 址:北京市东城区法华南里11号楼邮 编:100061附件:药包材急性全身毒性检查法公示稿(第二次).pdf药包材热原检查法公示稿(第二次).pdf药包材溶血检查法公示稿(第二次).pdf药包材细胞毒性检查法公示稿(第二次).pdf国家药典委员会2019年9月30日
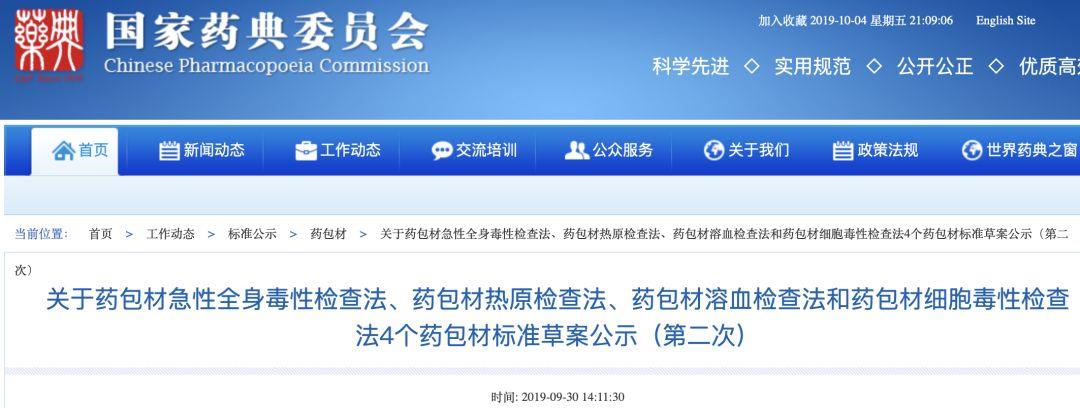
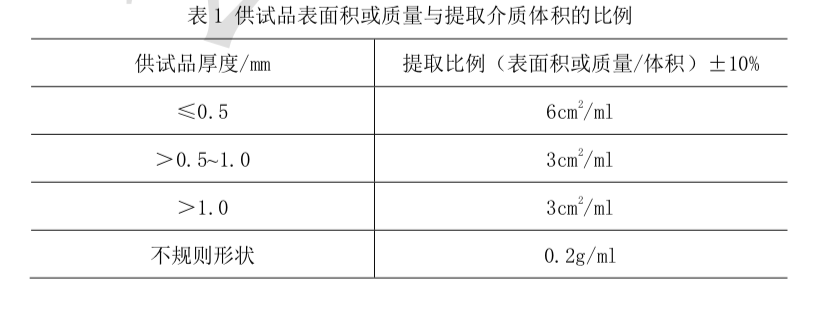
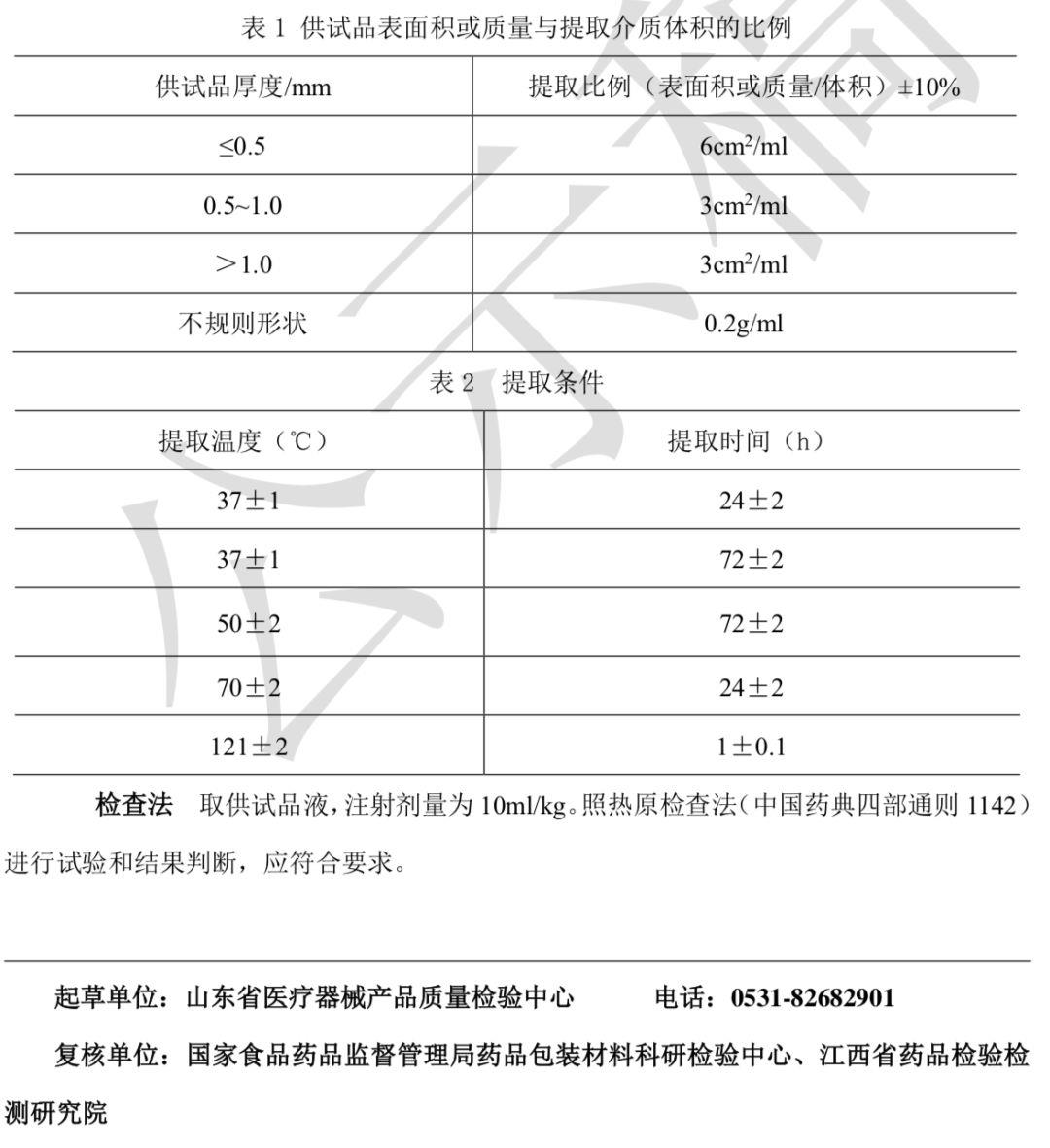
药包材急性全身毒性检查法本法系将一定剂量的供试品液注入小鼠体内,在规定时间内观察小鼠有无毒性反应和死 亡情况,以判定供试品是否符合规定的一种方法。试验动物 试验用小鼠应健康合格。须在同一饲养条件下饲养,同一来源,同一品种, 性别不限,体重17 g~23g。同一性别的动物体重差异应不超过平均值的±20%。如使用雌 性动物,宜未育并无孕。做过本试验的小鼠不得重复使用。将小鼠随机分为试验和对照两组, 每组5只。复试时每组取18g~19g的小鼠10只。供试品液的制备 制备过程应按无菌操作法进行。必要时,制备供试品液前先将供试品 置高压灭菌器内115°C保持30分钟。未灭菌供试品根据实际情况进行灭菌处理。除另有规 定外,按品种项下规定的提取介质制成供试品液,提取介质示例:a) 0.9%氯化钠注射液;b)新鲜精制植物油(如棉籽油等);c)1:20乙醇0.9%氯化钠注射液溶液;d) 聚乙二醇400(PEG400)。提取时应对供试样品进行分割,以使供试品能够放入容器并浸没在提取介质中进行充分提取,除另有规定外,切成0.5cm×3cm条状。不计算因分割而产生的表面积增加。由于完 整表面与切割表面可能存在潜在的提取性能差异,必要时可保持供试品的完整性。除有明确 规定的浓度和提取条件外,照下列表1和表2方式制备供试品液。所选择的提取条件不应该 引起供试品物理形态的改变。对照液 提取介质(不含有供试品)以相同的方式制备作为对照液。供试品液和对照液应在制备后24h内使用,注射前剧烈振荡,确保可提取物充分混匀。
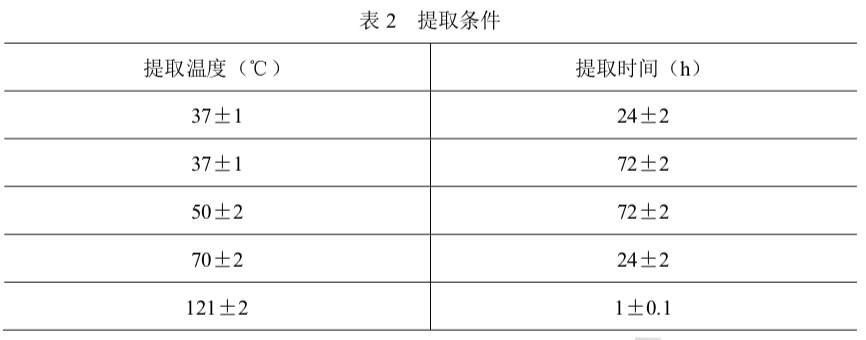
检查法 按照表3规定各组5只小鼠分别注射供试品液或对照液,注射速度为0.1ml/s。PEG400供试品液及介质对照液在注射前应使用0.9%氯化钠注射液以4.1倍稀释至终浓度200mg/ml后注射。注射后观察小鼠即时反应,并于4h、24h、48h、72h观察和记录试验组 和对照组动物的一般状态、毒性表现和死亡动物数。在72h时称量动物体重,动物反应观察 判定按表4进行。
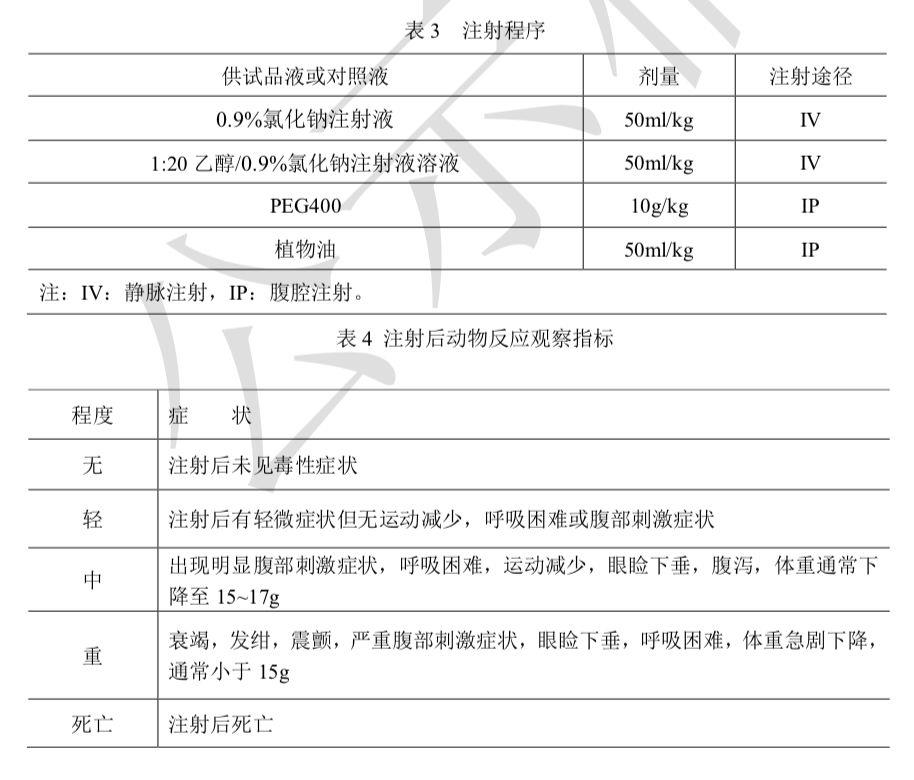
结果判定 如果观察期内供试品组动物的毒性反应不显著大于对照组动物,则判定供试 品合格。如果供试品组动物有2只或2只以上出现中度毒性症状或死亡,或有3只或3只以 上动物体重下降大于2g,则供试品不合格。如任何一供试品组动物显示有轻度的毒性反应, 并且不超过1只动物显示有中度毒性反应的大体症状或死亡,则另取10只动物进行复试。在72h观察期内,供试品组动物的反应不大于对照组动物,判定供试品合格。起草单位:山东省医疗器械产品质量检验中心 电话:0531-82682901复核单位:上海市食品药品包装材料测试所、北京市药品检验所
药包材热原检查法本法系将供试品液静脉注入家兔体内,在规定时间内,观察家兔体温升高情况,以判定 供试品中所含热原的限度是否符合规定。试验动物:应符合热原检查法(中国药典四部通则1142)中供试用家兔的规定。试验前的准备:应符合热原检查法(中国药典四部通则1142)中试验前准备的规定。供试品液制备:制备过程应按无菌操作法进行。将供试品用纯化水冲洗干净,用滤纸吸干。除另有规定外,切成0.5cm×3cm条状,不计算因分割而产生的表面积增加。除另有规 定外,供试品置高压灭菌器内115°C保持30分钟。照下列表1和表2方式制备供试品液。供试品液应在制备后2h内使用。
药包材溶血检查法本法系通过供试品与血液接触,测定红细胞释放的血红蛋白量以检测供试品体外溶血程 度的一种方法。试验前的准备 除另有规定外,采集健康家兔新鲜血液至抗凝采血管中,常见抗凝剂 有3.2%枸橼酸钠或2%草酸钾。取新鲜抗凝兔血8ml,加入0.9%氯化钠注射液10ml稀释。供试品的制备 称取3份供试品,每份5g,除另有规定外,一般切成0.5cm×2cm条状。由于完整表面与切割表面可能存在潜在的提取性能差异,必要时可保持供试品的完整性。检查法 除另有规定外,供试品组3支试管,每管加入供试品5g及0.9%氯化钠注射液10ml;阴性对照组3支试管,每管加入0.9%氯化钠注射液10ml;阳性对照管组3支试管, 每管加入纯化水10ml。全部试管放入(37±l)°C恒温水浴中保温30分钟后,每支试管加入0.2ml稀释兔血,轻轻混匀,置(37±l)°C水浴中继续保温60分钟。倒出管内液体离心5分钟 (2500r/min)。吸取上清液移入比色皿或酶标仪内,按照分光光度法(中国药典四部通则0401),于545nm波长处测定吸光度。结果计算 供试品组和对照组吸光度均取3支管的平均值。阴性对照管的吸光度应不 大于0.03;阳性对照管的吸光度应为0.8±0.3,否则重新实验。按下式计算

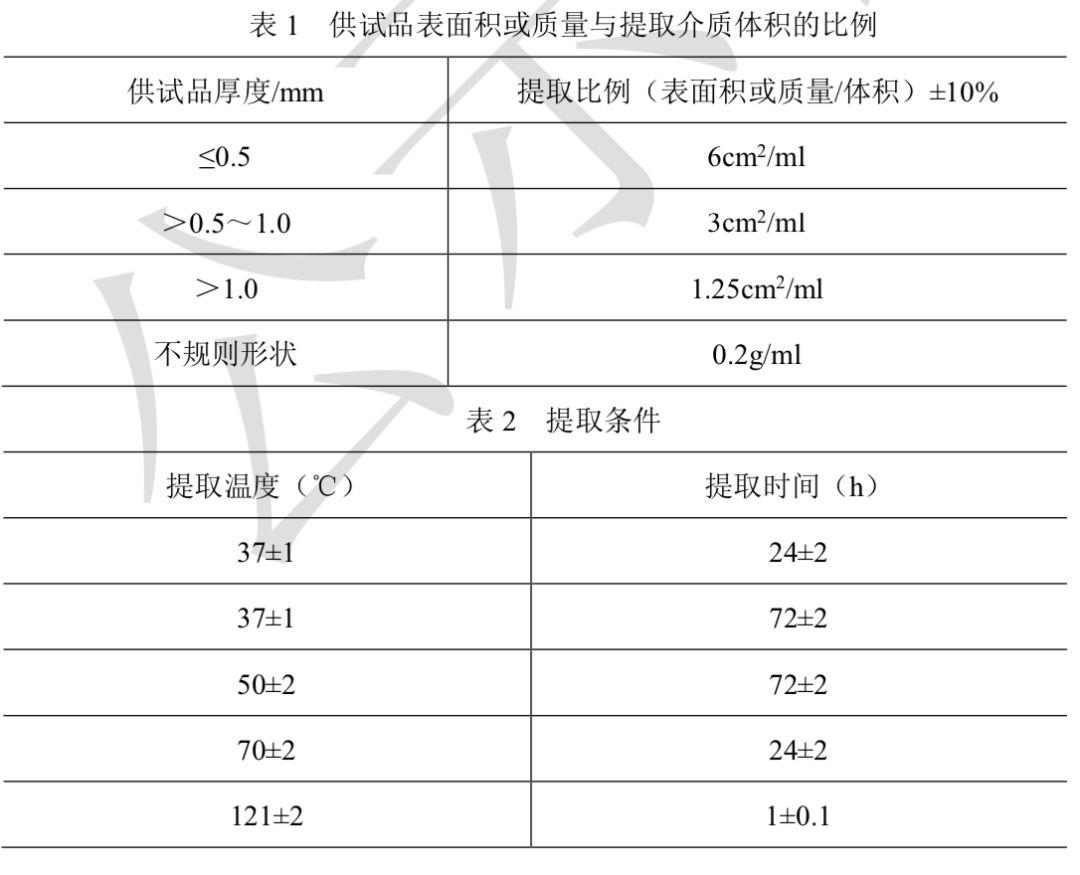
药包材细胞毒性检查法本法系将供试品或供试品液接触细胞,通过对细胞形态、增殖和抑制影响的观察,评价 供试品对体外细胞的毒性作用。试验用细胞 推荐使用小鼠成纤维细胞L-929。试验时采用传代48~72h生长旺盛的细 胞。试验前的准备 与样品及细胞接触的所有器具均需无菌。必要时可采用湿热灭菌如115°C保持30分钟;干热灭菌如250°C保持30分钟或用180°C保持2h。供试品液的制备 提取介质的选择宜反映出提取的目的,优先选用含血清哺乳动物细胞 培养基作为提取介质。除另有规定外,按品种项下规定的提取介质制成供试品液。将供试品 切成0.5cm×2cm条状,用湿热灭菌或紫外线照射消毒后,置玻璃容器内。除另有规定外, 按表1选择提取比例,使提取液浸没供试品,按表2选择提取条件(若采用含血清培养基, 应用(37±1)°C的条件)。
1.相对增殖度法阴性对照液制备 为不加供试品的细胞培养液。阳性对照液制备 取生物毒性阳性参比物质,照供试品制备项下的规定进行,如6.3%苯 酚的细胞培养液。
检查法取33个培养瓶,分别加入4×104个/ml浓度细胞悬液1ml,细胞培养液4ml, 置(37±1)°C,(5±1)%CO2的条件下培养24h。培养24h后弃去原培养液。
阴性对照组:取13个培养瓶加入5ml阴性对照液;阳性对照组 取10个培养瓶加入5ml阳性对照液;试验组:取10个培养瓶加入5ml含50%供试品液的细胞培养液,置(37±1)°C, (5±1)% CO2的条件下继续培养7天。细胞形态学观察和计数:在更换细胞培养液的当天,取3瓶阴性对照组,并在更换后第2、4、7天,每组各取3瓶进行细胞形态观察和细胞计数。毒性评定细胞形态分析标准按表3规定。
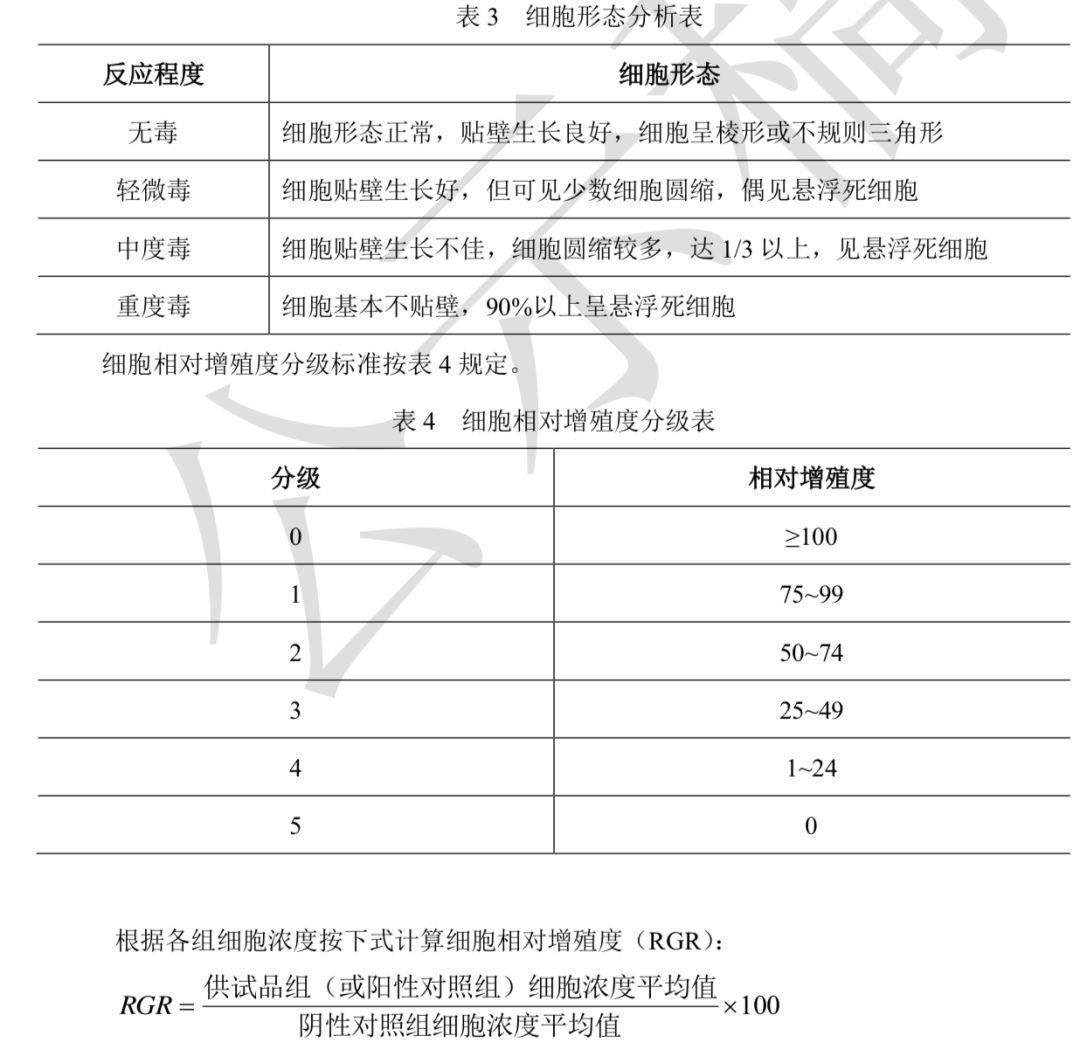
结果评价试验组相对增殖度(以第7天的细胞浓度计算)为0级或1级判为合格。试验组相对增殖度为2级,应结合形态综合评价,轻微毒或无毒的判为合格。试验组相对增殖 度为3级~5级判为不合格。
2琼脂扩散法供试品制备 将样品用纯化水冲洗干净(根据实际情况需要),用滤纸吸干。若用供试品液进行试验,将制备的供试品液附着到生物惰性吸收性的基质(例如超细硼硅玻璃纤维滤纸)上,制成面积不少于100mm2的圆形供试品。阴性对照制备 取无生物毒性阴性参比物质,例如高密度聚乙烯。按照供试品制备项下的规定进行。阳性对照制备 取生物毒性阳性参比物质,例如含二乙基二硫代氨基甲酸锌的聚氨酯(ZDEC)。按照供试品制备项下的规定进行。可采用10%二甲基亚砜(DMSO)溶液,附着到 生物惰性吸收性(例如超细硼硅玻璃纤维滤纸)的基质上。
检查法取细胞悬浮液(1×105个/ml)7ml,均匀分散至直径60mm的培养皿中。置于含(5±1)%CO2气体的细胞培养箱中培养24h至近汇合单层细胞,弃去培养皿中培养基,将溶化琼脂冷却至48°C左右与含20%血清的2倍新鲜哺乳动物细胞培养基混合,使琼脂最终质量浓度不大于2%,在每只培养皿内加入新制备的含琼脂培养基(要足够薄以利于可沥滤物的扩散)。含琼脂培养基凝固后,可用适当的染色方法染色。将供试品、阴性对照、阳性对照小心 地放在培养皿的固化琼脂层表面。每个供试品、阴性对照、阳性对照试样间尽量保持合适的距离并远离培养皿壁,每一培 养皿中放置不超过3个试样,每个试样至少设置2个平行。置(37±1)°C含(5±1)% CO2的 细胞培养箱中至少培养(24±2)h。用显微镜观察每个供试品、阴性对照、阳性对照试样反应 区域。用活体染料如中性红可有助于检测细胞毒性。
结果评价按表5进行细胞毒性评价和分级。如阴性对照为0级(无毒)、阳性对照不小于3级(中 度毒),则细胞培养试验系统有效。
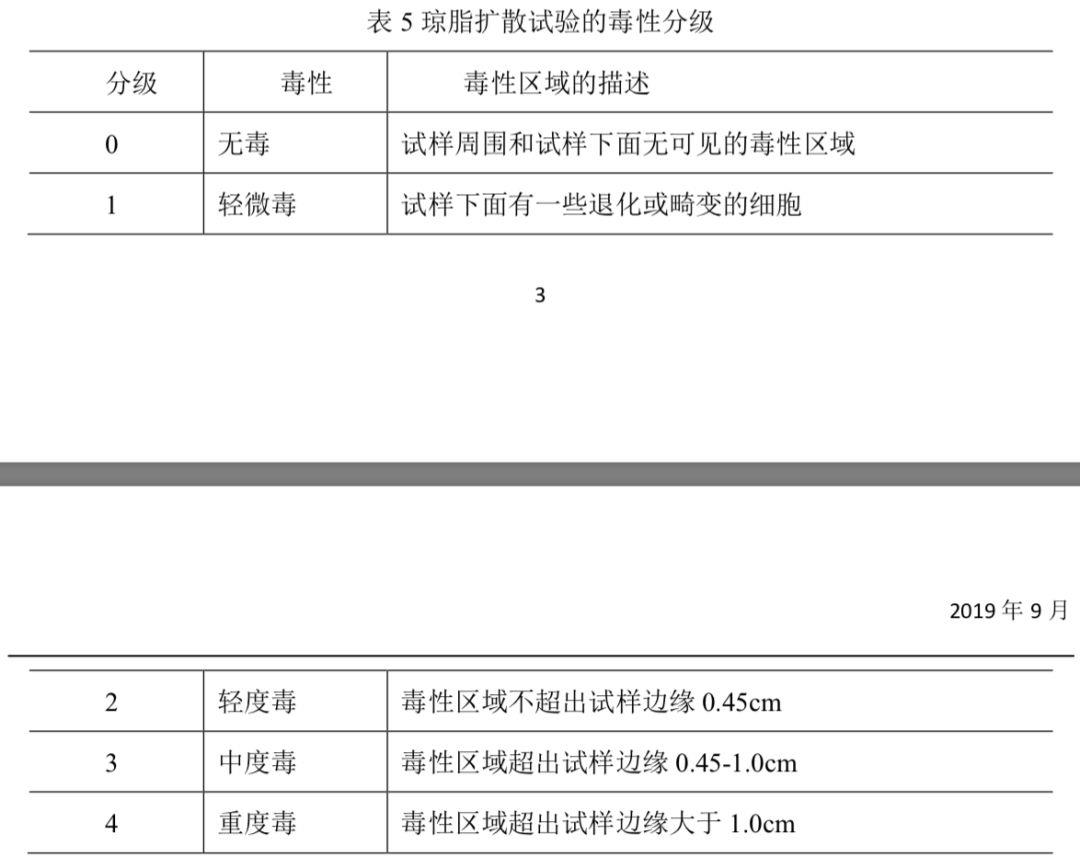
检测提取液时,供试品液的反应区域应减去介质对照的反应区域,再进行毒性分级。供试品和/或供试品液细胞毒性分级不大于2级(轻度毒)时,则判为合格。
3直接接触法供试品制备 采用供试品的平整部分,表面积不小于100mm2。阴性对照制备 取高密度聚乙烯参比物质,照供试品制备项下的规定进行。阳性对照制备 取生物毒性阳性参比物质,照供试品制备项下的规定进行。
检查法取生长旺盛的细胞悬浮液(1×105个/ml)2ml,置直径35mm的平皿中培养单层细胞。置于细胞培养箱中培养24h至近汇合单层细胞,吸去培养基,替换为0.8ml的新鲜培养基。在每个培养皿中单独放置1个供试品、阳性对照或阴性对照,每个试样至少设置2个平行。将所有的培养物置(37±1)°C含(5±1)% CO2的细胞培养箱中至少培养24h,培养 箱宜保持适当的湿度。显微镜下观察每个供试品、阴性对照、阳性对照周围,必要时应进行 染色。
结果评价按照琼脂扩散法结果评价项下的规定进行。若样品不超过2级(轻微毒),则 样品判为合格。若试验系统无效需重复试验过程。
4提取法阴性对照制备 取高密度聚乙烯参比物质,照供试品溶液制备项下的规定进行。阳性对照制备 取生物毒性阳性参比物质,照供试品溶液制备项下的规定进行。检查法 取生长旺盛的细胞悬浮液(1×105个/ml)2ml,置直径35mm的平皿中培养单层细胞。培养不少于24h细胞至少达到80%近汇合后,吸去培养基,替换为供试品液、阴性 对照液或阳性对照液。含血清培养基提取液和不含血清培养基提取液无需稀释,平行试验2份。0.9%氯化钠注射液为介质的提取液用含血清的细胞培养基稀释至提取液浓度为25%, 平行试验2份。所有的培养物在(37±1)°C,含(5±1)%CO2的培养箱中培养48h。48h后, 在显微镜下观察培养物,如有必要,进行染色。结果评价 按表6进行毒性评价和分级。若试验系统不成立,重复试验。供试品不超过2级(轻微毒),则判为合格。如需进行剂量-反应程度评价,可通过定量稀释供试品液,重复试验。
更多关于药包材各种测试标准及方法解读,可联系以上联系方式,也可随时致电:0531-67808296。


